8 min read
2022-NMicro-Dodd
2022-07-19

为什么读这篇文章
- 这是Dylan Dodd最新的一篇文章
- 这篇文章其实和他2017年的Nature paper以及2019年Annu Review都有一些关联
- 是一篇很好应用代谢组学方法来研究microbiome的示范
Background
- 肠道细菌的一个key problem是如何获取能量来维持它们的生长和physiology
- Clostridium sporogenes 利用amino acids对来获取能量 (即Stickland reaction)。在以往的认知里,该途径通过oxidative pathways来产生APT,而通过reductive pathways来维持氧化还原平衡。
- 但是有一些线索也表明reductive pathways也与能量守恒相关,具体有
- proline reduction会产生质子进入细胞
- cinnamic acid reduction 与ATP形成相关
- aromatic amino acid代谢的gene cluster携带了birfurcating Acyl-CoA dehydrogenase,表明这个通路可能与能量形成相关,并涉及Rnf complex
- 尽管有这些证据表明microbial metabolites可能来源于产生能量的catabolic pathways,但是缺乏实验证据
- amino acid pairs在多大程度上被用于促进C. sporogenes生长
- 哪些C. sporogenes 代谢物被gut产生并进入host
- reductive stickland metabolism是否与ATP的形成相关
- Rnf complex在amino acid metabolism以及in vivo fitness过程中起到什么作用
- 这篇文章主要做的点,是研究这个还原途径是否也会产生energy,以及产生的microbial metabolites 是否会进入循环系统并影响host physiology
Results
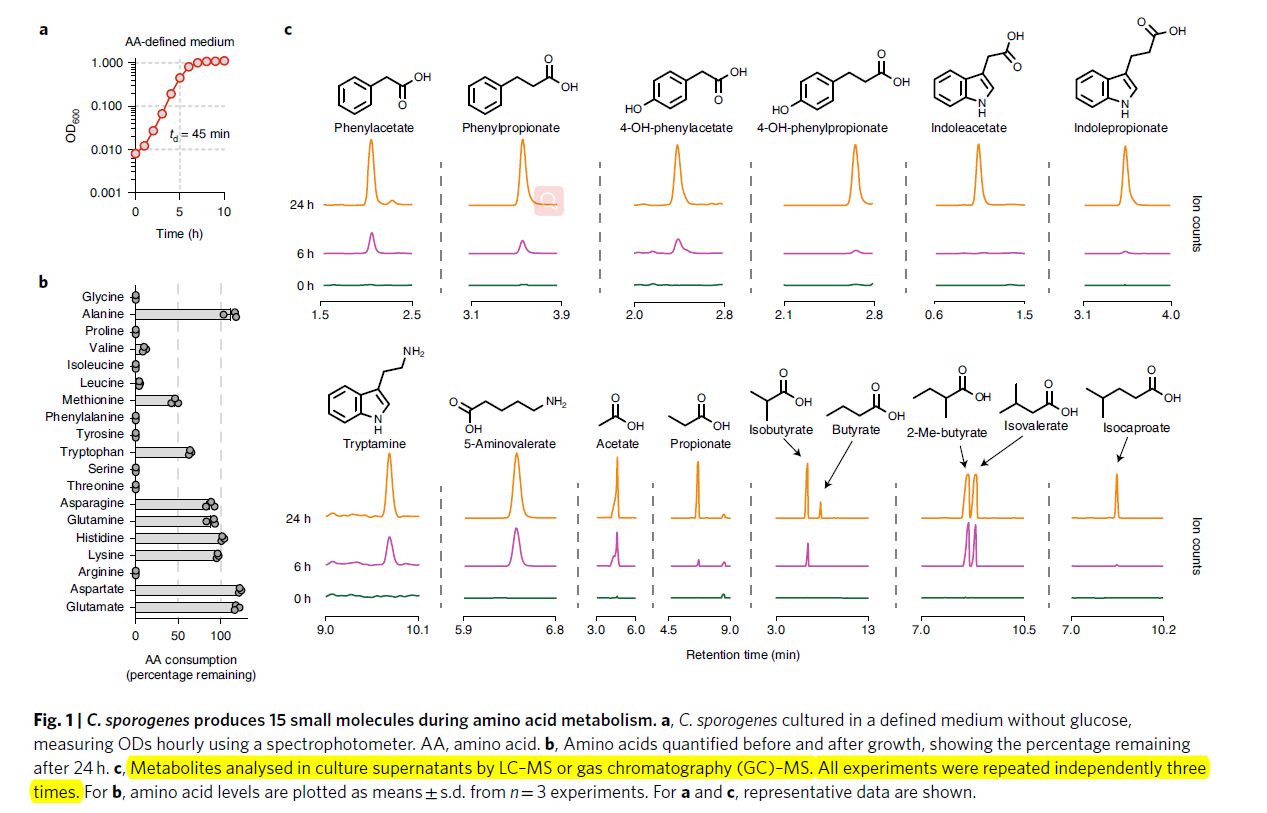
- C. sporogenes ATCC (American Type Culture Collection) 15579是一个从人类粪便中分离出来的蛋白水解厌氧菌,能够进行遗传编辑,从而是一个理想的model来进行研究
- 在没有glocuse的条件下,发现C.sporgenes也能快速生长 (Fig 1a)
- 在24h生长后,培养基中的氨基酸被消耗(Fig 1b), 并有15个代谢物在培养上清液中出现了累积(Fig 1c),包括SCFA, Branched-chain fatty acids,以及aromatic fatty acids and amines.
- 尽管这些代谢物是已知累积在human gut,但是生成宿主对代谢物的代谢途径还不是很清楚
C. sporogenes uses amino acids in ‘Stickland’ pairs.
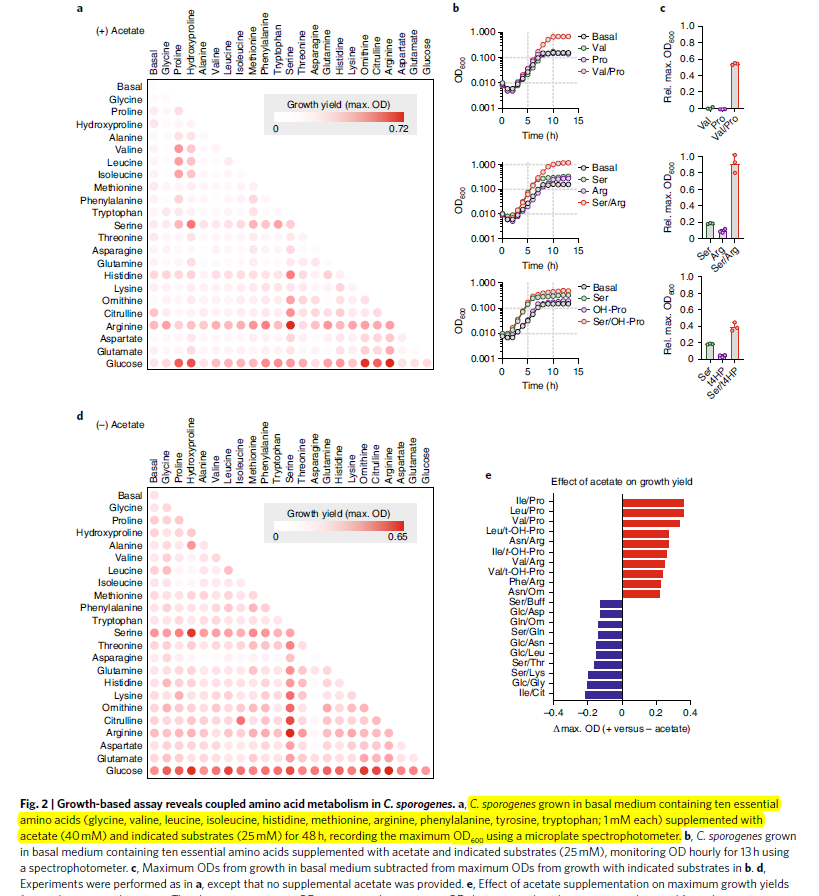
- 之前的研究表明C. sporgenes可以代谢amino acids in pairs, 通过stickland reaction。已知的可以促进菌群生长的pair包括:Arg/Ile, Ser/Pro, Val/Pro, Leu/Pro以及Ile/Pro, 但是全面的growth-promoting stikland pairs还没有被分析过
- 作者进行了一个high-throughput, growth-based assay, 利用OD值进行评估,在加不加acetate的情况下,分析生长情况
- 发现有一些substrate 组合可以大大增加生长速度。glucose是最robust,可以利用多种还原途径的底物,比如proline, arginine (Fig2a)
- 此外,serine的comination也与glucose展示出类似的谱图,因为只需1步就能转变到pyruvate,从而通过底物的氧化磷酸化生成ATP (Fig 2a)。在作者的assay中,Ser/Arg组合显示出了最高的生长率,比其他高3倍以上(Fig 2b-c)。这个过程不需要acetate, 可能表明serine能够通过pyruvate来进行anabolic reaction
- 另外加不加acetate显示出很明显的不同。在top10的stickland pairs中,8个BCFA(reductants)加proline或者proline类似amino acid (oxidants) ,表明这样的组合可以满足细胞的合成反应
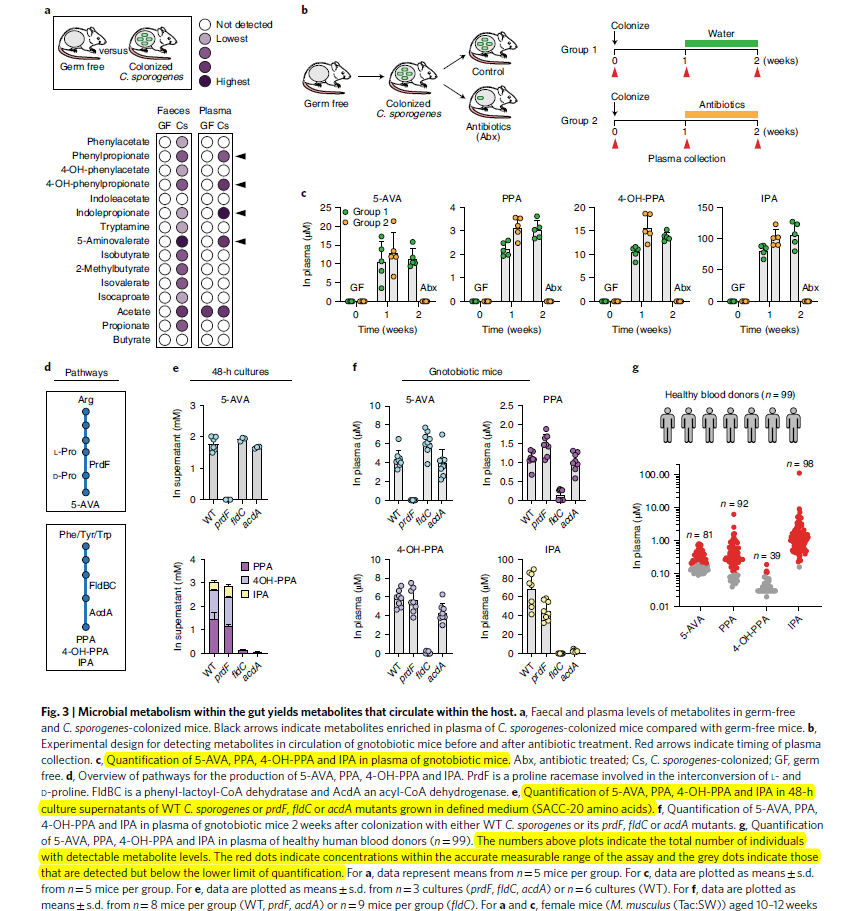
- 为了评估C.sporgenes共享了哪些代谢物到host,进行了菌群移植,并对faeces, caecal contentes, plasma, 以及urine进行了绝对定量
- 13 out of 15 metabolites 在faeces中被detected,经过1week colonization,其中4个能在plasma中鉴定到,包括5-aminovalerate (5-AVA), phenylpropionate (PPA), 3-(4-hydroxypheny)propionate (4-0H-PPA), indole-propionate,1week后平均浓度~3uM (PPA), ~100uM (IPA) (Fig 3a-b)
- 抗生素处理后均下降到了检测限以下,证明它们是依赖于bacterial metabolism (Fig3b-c)
- 这说明colonization可能引入了新的pathway到host来生成了这4个compounds
- 针对5-AVA,构建了prdF mutant, 这个酶是控制L-Pro -> D-Pro转化的过程(Fig3d)。这个突变能够完全消除5-AVA (Fig3e)
- 针对PPA,4-OH-PPA, 以及IPA构建了fldC以及acdA mutant,都能消除对应的代谢产物。colonization到小鼠上之后也都能重复(Fig3f)
- 这些结果证明通过bacteria colonization可以引入代谢通路产生上述代谢物
- 这4个circulating metabolites也存在于human blood当中(Fig3g)
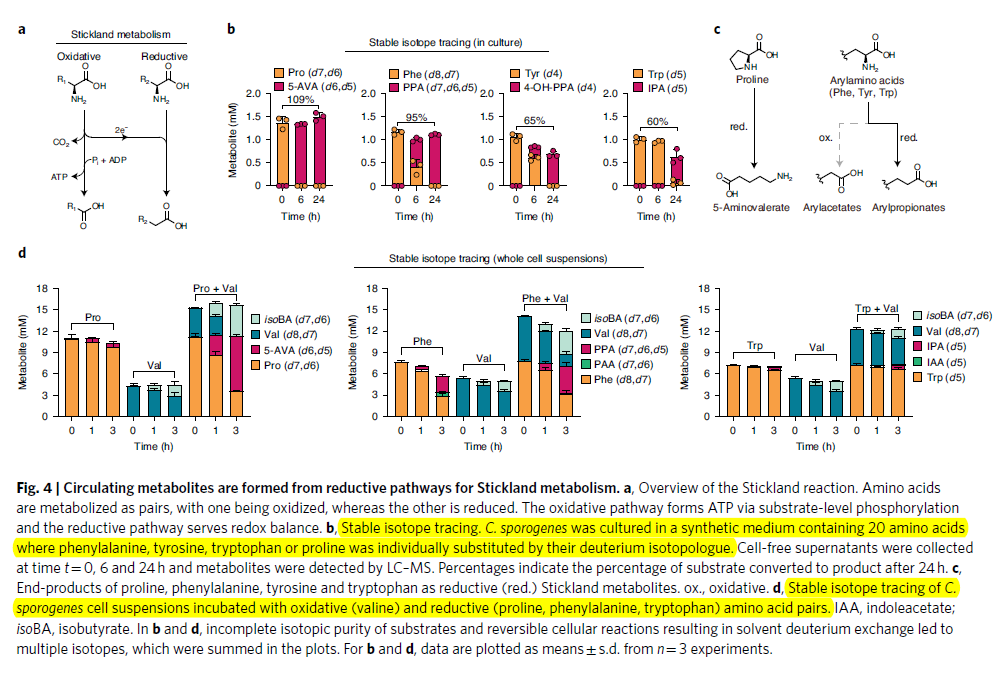
- 为了验证这4个循环代谢物是否来源于相同的amino acid, 进行了氘标实验。分别在培养基中加入4中氘标的氨基酸,在24h后基本上都被消耗完全完,生成对应的labelled derivatives (5-AVA (d6,d5), PPA (d7,d6,d5), 4-OH-PPA(d4)) (Fig4b)。尽管也存在其氧化通路,但是只有还原通路的产物被观察到
- 然后进一步验证这些reductive metabolites的产生是否是受到氧化氨基酸伴侣的刺激。介于proline和valine单独刺激显示出先相对有限的substrate consumpation,使用两者共同刺激显示出了明显的消耗(Fig4d)。同样使用Phe/Val, 以及Trp/Val(Fig4d)。这些共同证明这些还原代谢物与coupled stickland reaction相关
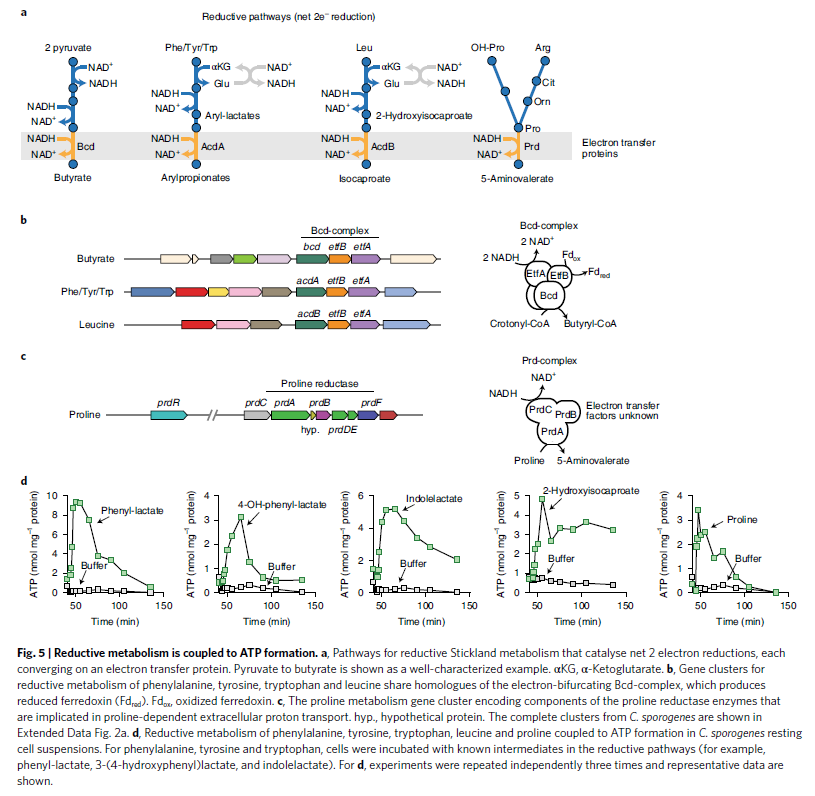
- 在经典的amino acid的Stickland metabolism中,氧化途径通过底物氧化磷酸化产生ATP,而还原途径主要是是维持氧化还原平衡。但是厌氧细菌却可以使用reductive metabolism来维持厌氧反之,这表明还有另外一种机制来获取能量。
- 作者怀疑stickland的还原途径是否能够获得能量,因此进行了gene cluster分析,reductive amino acid patheay, 来发现潜在的能量获取机制
- 发现每一个pathway都有一步设计了multi-subunit electron transfer protein (Fig 5a). 这个aryl amino acid reductive gene cluse编码了acyl-coA途径,sharing 40-60%的氨基酸一致性(Fig 5b) Etfbcd)。对于proline,则有一种不同的electron transfer protein, proline reductase (Fig 5c). 这些BGC表明stickland的还原途径与electron transfer reaction有关,可能能产生ATP
- 为了试验进行验证,作者搭建了一个whole-cell-based ATP assay使用C. sporogenes 的细胞悬浮液。然后使用还原途径的中间产物到细胞中,发现ATP水平确实有一个明显的上升(Fig.5d). 这些表明reductive Stickland metabolism 确实与ATP的形成相关,并生成了一个proton的驱动力
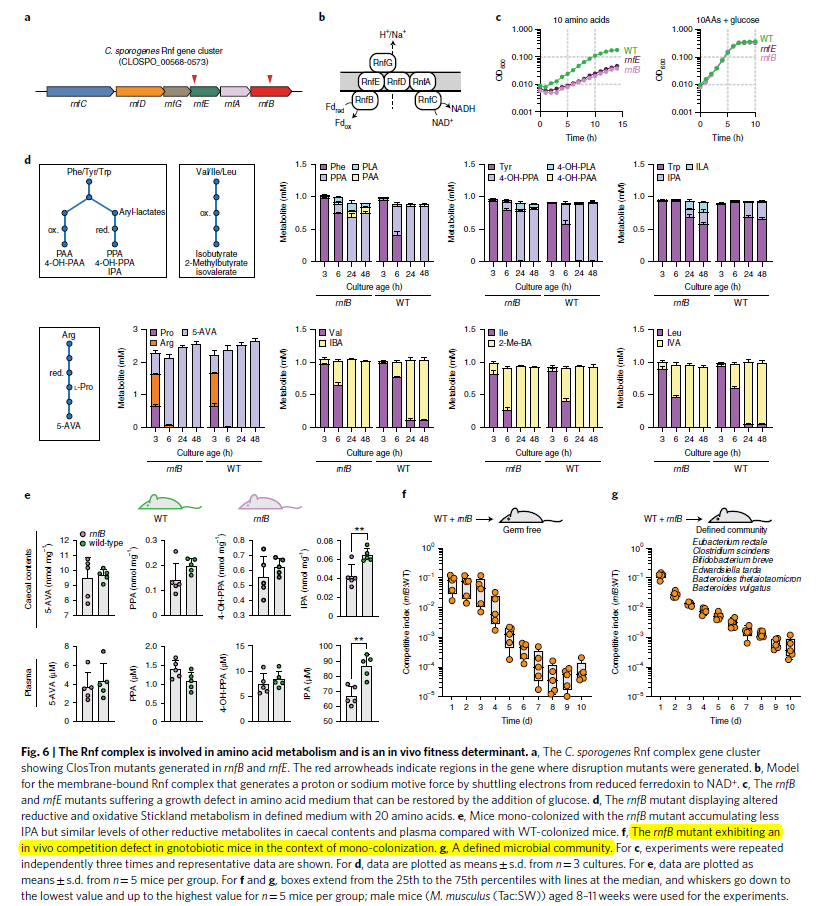
- 作者去探究Rnf complex是否可能是一个重要的结合位点,通过gene cluster分析发现Rnf complex以及targeted gene (rnfB, rnfE)编码了2个subunits (Fig 6a). RnfB被认为是一个Rnf complex的入口,而RnfE则被认为是一个跨膜的protein (Fig 6b). - 两者任何一个的突变都会影响生长速率,但当加入glucose时,则可以抑制这种表型(Fig6c)
- 相比于WT, rnfB的突变株消耗phenylalaning和tyrosine的速度要更慢,同时中间产物3-(4-hydroxyphenyl)lacate则有累积,表明这个还原途径被局部block了 (Fig 6d)。rnfB的突变株也会产生更少的IPA,积累更多的中间产物
- 消耗Arg和Pro的途径与WT组没有明显变化,但是5-AVA的生成速率要明显更底(图上看不出来),但有意思的一点是突变株消耗了更多的branched-chain amino acids,将它们covert成氧化产物(IBA, 2-Me-BA, IVA) (Fig 5d)
- 这些说明rnfB确实会影响reductive Stickland metabolism, 从而有利于氧化通路代谢产物的生产。但是这个突变没有完全被blocked住,证明细胞还有其他途径来进行电子传递
- 最后作者去探究in vivo中,stickland metabolties在Rnf complex 突变的条件下是否会改变。对突变和非突变的菌株进行coloniation, 然后有LC-MS来测量caecal contents和plasma. 相比于WT, rnfB突变组有相似的还原通路产物(没有明显差异),除了IPA (Fig6e)。因此,尽管Rnf complex可以影响stickland metabolism在培养基中,但是在mammalian intestin中会被回补掉
The Rnf complex is a fitness determinant within the gut.
- 考虑到之前发现Rnf complex突变会在体外影响生长速率,作者就进一步去验证在体内是否有同样重要。同时移植WT和rnf突变,会发现rnf会被迅速的替代掉 (Fig. 6f),在更复杂的移植条件下也是类似的(Fig. 6g)。
- 这些结果表明Rnf complex能够帮助更有效的代谢,可能是通过link reductive stickland metabolism来产生proton gradient,进而产生ATP
Electron transfer proteins are widely distributed.
- 进一步在NCBI的GenBank database中证明了Electron transfer protein是普遍存在的
感受
- 文章逻辑还是清晰的,证明了reductive stickland 反应产生了一些循环代谢物,并且可以生成ATP。另外这篇文章还是能够看到前一篇2017年nature文章的一些点
- 目前可以看到他们组主要还是分析一些常见的菌群代谢产物,15种,数目不是很多,但是做了很不错的绝对定量结果






